Professional Documents
Culture Documents
Termodinánica
Uploaded by
explomolinCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Termodinánica
Uploaded by
explomolinCopyright:
Available Formats
Principios de termodinmica
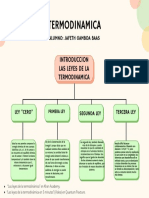
INTRODUCCIN
LA TERMODINMICA ES UNA CONSECUENCIA LGICA DE DOS AXIOMAS FSICOS ELEMENTALES:
LA LEY DE CONSERVACIN DE LA ENERGA LA LEY DE DEGRADACIN DE LA ENERGA
INTRODUCCIN
LA TERMODINMICA NACE COMO UNA NECESIDAD PARA EL PERFECCIONAMIENTO TRMICOS. Y DESARROLLO DE LOS MOTORES
ACTUALMENTE, ES UNA BASE DE CONOCIMIENTO DE TODA LA FSICA
INTRODUCCIN
OTRA DEFINICIN DE TERMODINMICA: Ciencia que estudia todas las transformaciones de unas formas de energas en otras y tambin la transmisin o transferencia de determinada clase de energa. La Termodinmica se desarrolla a partir de cuatro Principios o Leyes:
Principio Cero: permite definir la temperatura como una propiedad. Primer Principio: define el concepto de energa como magnitud conservativa.
Segundo Principio: define la entropa como medida de la direccin de los procesos.
Tercer Principio: interpretacin fsica de la entropa como orden de los sistemas. Postula propiedades en el cero absoluto de temperatura.
4
INTRODUCCIN
LA LEY DE DEGRADACIN INDICA QUE LA ENERGA QUE INTERVIENE EN UN PROCESO REAL PIERDE CALIDAD. ESTA PRDIDA DE CALIDAD COSTE ECONMICO.
INTRODUCCIN
EL CALOR Y LA ENERGA DE LOS SISTEMAS SON SOLO PARCIALMENTE TRANSFORMABLES EN TRABAJO ENERGA DE BAJA CALIDAD.
z Parte de la energa transformable en trabajo Exerga. z Parte de la energa no transformable Anerga.
EN
CUALQUIER
PROCESO
ENERGTICO
EXISTE
UNA
DESTRUCCIN DE EXERGA TRANSFORMACIN DE EXERGA EN ANERGA.
6
INTRODUCCIN
Si nos fijamos en la meta del segundo principio de la Termodinmica, el clculo de la exerga destruida, la entropa, que ha estado envuelta en un halo misterioso, aparece como algo natural: como una funcin necesario para que el clculo sea posible.
PRINCIPIOS TERMODINMICOS DEFINICIONES Y CONCEPTOS PRELIMINARES
CONCEPTOS PRELIMINARES
CONCEPTOS PRELIMINARES
1. 2. 3. 4. 5.
SISTEMA TERMODINMICO ESTADO DE UN SISTEMA PROPIEDADES DE ESTADO PROCESOS Y CAMBIOS DE ESTADO PRINCIPALES PROPIEDADES DE ESTADO: p, v, T
CONCEPTOS PRELIMINARES
1. SISTEMA TERMODINMICO Una etapa importante de cualquier anlisis de ingeniera consiste en describir con precisin lo que se est estudiando. En termodinmica se utiliza el trmino sistema para identificar el objeto de nuestro anlisis. La Termodinmica tiene por objeto el estudio de las leyes de transferencia de energa en sistemas en equilibrio.
10
CONCEPTOS PRELIMINARES
SISTEMA TERMODINMICO Se trabaja con sistemas macroscpicos: Aquellos que estn constituidos por un gran nmero de partculas, siendo sus dimensiones notablemente ms grandes que las de los tomos o las molculas y estn confinados por una superficie cerrada, real o ideal, de forma que a su travs puede haber flujos de partculas y de energa.
11
CONCEPTOS PRELIMINARES
SISTEMA TERMODINMICO Es una porcin del universo objeto de estudio. Es una cantidad de materia, de masa e identidad fija, que se toma como base en un determinado estudio. Un sistema es una regin restringida, no necesariamente de volumen constante, ni fija en el espacio, en donde se puede estudiar la transferencia y transmisin de masa y energa.
12
CONCEPTOS PRELIMINARES
SISTEMA TERMODINMICO Todo sistema queda limitado por un contorno, paredes, fronteras o lmites del sistema, que pueden ser reales o imaginarios. Tambin se llaman superficie de control. El medio rodeante o entorno es la parte del universo prxima al sistema y que se ve afectada en alguna medida por los procesos que ocurren en el sistema. Todo lo que queda fuera del sistema se conoce como los alrededores o el ambiente.
13
CONCEPTOS PRELIMINARES
SISTEMA TERMODINMICO Toda intercambio entre el sistema y los alrededores implica algn tipo de transferencia que se realiza a travs de la frontera. De esta manera, los alrededores no estn constituidos por todo el Universo, sino solamente por aquella parte del mismo que afecta o se ve afectada por el sistema.
14
CONCEPTOS PRELIMINARES
TIPOS DE SISTEMAS TERMODINMICOS
Sistemas abiertos. Sistemas cerrados. Sistemas aislados. Sistema en estado
estacionario.
Sistema en estado
transitorio.
15
CONCEPTOS PRELIMINARES
TIPOS DE SISTEMAS TERMODINMICOS Sistemas abiertos, hay flujos de materia y/o energa, con el medio exterior. Tambin se les denomina volumen de control, ya que su volumen permanece constante.
16
CONCEPTOS PRELIMINARES
TIPOS DE SISTEMAS TERMODINMICOS Sistemas cerrados, tienen un nmero de partculas constante. A travs de la pared cerrada que les limita puede haber flujo de energa, pero no de materia. Tambin llamados masa de control.
receptor mecnico
p S F
II
17
CONCEPTOS PRELIMINARES
18
CONCEPTOS PRELIMINARES
TIPOS DE SISTEMAS TERMODINMICOS Sistemas aislados, que son aquellos que no intercambian ni masa ni energa a travs de su superficie. Por ejemplo, un gas encerrado en un cilindro de volumen constante y de paredes impenetrables al calor, paredes adiabticas, constituye un sistema razonablemente aislado. Sistema en estado estacionario: las propiedades del sistema no varan con el tiempo durante el proceso. Sistema en estado transitorio: las propiedades varan con el tiempo durante el proceso.
19
CONCEPTOS PRELIMINARES
20
CONCEPTOS PRELIMINARES
LMITES DE LOS SISTEMAS Los lmites de los sistemas pueden ser:
Adiabticos, cuando no pueden ser atravesados por el calor. Diatrmicos, si permiten la transferencia del calor. Rgidos, si no permiten el cambio de volumen. Permeables o semipermeables, cuando a travs de las paredes del
sistema puede pasar cualquier clase o slo determinadas sustancias respectivamente.
21
CONCEPTOS PRELIMINARES
2. ESTADO DE UN SISTEMA El estado termodinmico es una condicin del sistema definida por determinados valores de sus propiedades termodinmicas. Estados idnticos de un sistema, presentan los mismos valores en sus propiedades, independientemente del proceso o transformaciones que haya podido efectuar para alcanzarlo. Las magnitudes que slo son funcin de los parmetros independientes en el instante considerado, son las funciones de estado (tambin propiedades o parmetros de estado).
22
CONCEPTOS PRELIMINARES
ESTADO DE UN SISTEMA El valor de las restantes propiedades se puede medir o calcular a partir de las funciones de estado no puede darse arbitrariamente. As pues, cada tres propiedades estn relacionadas entre s. Ejemplo: entra la presin, la temperatura y el volumen especfico se tendra: F(p,v,T) = 0
Ecuacin de estado 23
CONCEPTOS PRELIMINARES
3. PROPIEDAD DE UN SISTEMA Cualquier magnitud fsica evaluable de un sistema, es decir, medible. Solamente pueden ser clasificadas como propiedades aquellas caractersticas del sistema que no dependen de la forma en que fue adquirida. Una propiedad no depende de la historia del sistema ni de su entorno, sino de las condiciones del mismo en el momento de la medida. EJEMPLO: El trabajo y el calor no son propiedades porque son cosas que se hacen sobre el sistema -produciendo un cambio en sus propiedades- y no cosas que tiene el sistema.
24
CONCEPTOS PRELIMINARES
25
CONCEPTOS PRELIMINARES
PROPIEDAD DE UN SISTEMA Se pueden clasificar las propiedades como:
Propiedades extensivas: dependen de la masa del sistema el volumen, y todas las
clases de energa. Son aditivas (su valor es la suma de los valores de la partes en las que se subdivida). Para designarlas se utilizan letras maysculas (la masa m es una excepcin importante).
Propiedades intensivas: Se definen en un punto. Son independientes del tamao,
masa o magnitud del sistema: por ejemplo la presin, temperatura, viscosidad y altura. Las propiedades extensivas se convierten en intensivas si se expresan por unidad de masa (propiedad especfica), de moles (propiedad molar) o de volumen (densidad de propiedad). Se representan con letras minsculas, con la excepcin de la temperatura T.
26
CONCEPTOS PRELIMINARES
27
CONCEPTOS PRELIMINARES
ECUACIN DE ESTADO La expresin matemtica real de la ecuacin de estado es diferente para cada sustancia y en general, difcil de determinar. Muchas veces se va a datos empricos se determinan en laboratorio y se obtienen en forma de tabla. Se podra buscar una ecuacin matemtica que al utilizarla nos diera los valores ensayados.
28
CONCEPTOS PRELIMINARES
FUNCIN DE ESTADO Como se haba comentado, una funcin de estado es una propiedad que puede expresarse como funcin de parmetros independientes: u = u (v,T) f(u,v,T)=0
Cualquier magnitud fsica que pueda expresarse en funcin de dos propiedades ser tambin una propiedad del sistema.
29
CONCEPTOS PRELIMINARES
CARACTERSTICAS FUNCIONES DE ESTADO dX es una diferencial exacta (su variacin independiente de la historia previa del sistema) dx es independiente del camino. dx = 0 Sea la propiedad de un sistema, que depende de las propiedades x e y. Si las propiedades x e y definen completamente al sistema = (x,y) es una funcin de estado. De esta manera, un pequeo cambio en la propiedad (d) puede explicarse por pequeos cambios en las propiedades x (dx) e y (dy) de acuerdo con: d = (j/jx)y dx + (j/jy)x dy
30
CONCEPTOS PRELIMINARES
4. PROCESOS Y CAMBIOS DE ESTADO ESTADO DE EQUILIBRIO Un sistema est en equilibrio cuando el valor de sus propiedades es el mismo en todos sus puntos. Qu pasa cuando una causa circunstancial origina en alguna parte del sistema una variacin de sus propiedades? Evoluciona espontneamente para restablecer el equilibrio.
31
CONCEPTOS PRELIMINARES
PROCESOS Y CAMBIOS DE ESTADO ESTADO DE EQUILIBRIO Cuando un sistema pasa de un estado a otro, los estados intermedios no sern en rigor de equilibrio. Sin embargo, Hay ocasiones en las que casi los son y as se consideran. Otras ocasiones no pueden considerarse como tales.
32
CONCEPTOS PRELIMINARES
PROCESOS Y CAMBIOS DE ESTADO EJEMPLOS 1. LIBRE EXPANSIN DE UN SISTEMA. 2. EXPANSIN RESISTIDA. 3. CALENTAMIENTO O ENFRIAMIENTO. 4. MEZCLA DE SISTEMAS.
33
CONCEPTOS PRELIMINARES
PROCESOS Y CAMBIOS DE ESTADO LIBRE EXPANSIN DE UN SISTEMA. Cuando la fuerza interior debida a la presin es mayor que la exterior F contra la cual se est expandiendo. Tanto ms libre cuanto mayor las diferencias de fuerzas. En ellas, el valor de las propiedades del sistemas en las situaciones intermedias pueden ser muy diferentes de unas zonas a otras no son ni pueden considerarse de equilibrio.
34
CONCEPTOS PRELIMINARES
PROCESOS Y CAMBIOS DE ESTADO EXPANSIN RESISTIDA Cuando la diferencia de fuerzas se mantiene infinitesimal durante todo el recorrido del mbolo se pueden considerar de equilibrio los estados intermedios.
35
CONCEPTOS PRELIMINARES
PROCESOS Y CAMBIOS DE ESTADO CALENTAMIENTO O ENFRIAMIENTO El sistema solo en equilibrio cuando se alcance la temperatura del medio exterior. En la prctica los estados intermedios se asemejan mucho al equilibrio.
36
CONCEPTOS PRELIMINARES
PROCESOS Y CAMBIOS DE ESTADO MEZCLAS DE DIFERENTES SISTEMAS Puede tratarse de una mezcla de fluidos, Iguales con diferentes temperaturas y/o presiones. Diferentes con la misma temperatura y/o presin. Diferentes con distintas presiones y/o temperaturas. En cualquiera de los casos las concentraciones intermedias hasta alcanzar el equilibrio pueden ser muy diferentes de unas zonas a otras.
37
CONCEPTOS PRELIMINARES
38
CONCEPTOS PRELIMINARES
PROCESOS Y CAMBIOS DE ESTADO PROCESO
Un proceso es una sucesin de transformaciones, interacciones y/o actuaciones de un sistema determinado. Un sistema experimenta un proceso, cuando se verifica un cambio de estado. Una transformacin termodinmica es la sucesin de estados por los que un sistema pasa cuando se le somete a un cambio.
39
CONCEPTOS PRELIMINARES
PROCESOS Y CAMBIOS DE ESTADO PROCESO
Cuando un sistema pasa de un estado a otro, la variacin de sus propiedades slo depende del estado inicial y final, y no de las situaciones intermedias.
La ecuacin de estado relaciones las propiedades en cada punto: f (p,v,T) = 0
40
CONCEPTOS PRELIMINARES
PROCESOS Y CAMBIOS DE ESTADO TIPOS DE PROCESOS
Proceso cclico. Proceso cuasiesttico. Proceso no esttico. Proceso reversible. Proceso irreversible.
41
CONCEPTOS PRELIMINARES
PROCESOS Y CAMBIOS DE ESTADO TIPOS DE PROCESOS
Proceso cclico. El estado final coincide con el inicial. Cuando un proceso se repite varios veces (o de forma indefinida) pasando siempre el camino recorrido o las etapas del proceso. A esta transformacin cerrada se le denomina tambin ciclo.
42
CONCEPTOS PRELIMINARES
PROCESOS Y CAMBIOS DE ESTADO TIPOS DE PROCESOS Proceso cuasiesttico. Todos los estados intermedios del proceso son estados de equilibrio.
. 1
Este proceso realmente no existe, es ideal.
. 2
Puede aproximarse tanto ms cuanto la causa o potencial dirigente del proceso
. 3
vara en cantidades cada vez ms pequeas. La representacin en un diagrama vendr dada por una curva continua.
. 4
43
CONCEPTOS PRELIMINARES
PROCESOS Y CAMBIOS DE ESTADO TIPOS DE PROCESOS Proceso no esttico. Cuando no cumple las condiciones anteriores. Son los procesos de igualacin.
44
CONCEPTOS PRELIMINARES
PROCESOS Y CAMBIOS DE ESTADO TIPOS DE PROCESOS Proceso reversible. Es un proceso cuasiesttico, que puede ser llevado de nuevo al estado inicial pasando por los mismos estados intermedios que el proceso directo, y sin que al final, ni en el sistema ni en el medio rodeante, quede ningn efecto residual que pueda revelar que se ha verificado el proceso. Para que esto ltimo suceda, no debe haber rozamientos ni deformaciones efectos disipativos. ADELANTO no habr degradacin de la energa y por ello ninguna generacin o produccin de entropa.
45
CONCEPTOS PRELIMINARES
PROCESOS Y CAMBIOS DE ESTADO TIPOS DE PROCESOS Proceso reversible. El proceso reversible es ideal, ya que en la prctica no existen procesos que tengan todas sus caractersticas ste representa un lmite al desempeo de un proceso real. En termodinmica, lo usual es calcular el trabajo hecho para procesos reversibles, debido a la facilidad con la que puede hacerse el anlisis matemtico a stos.
46
CONCEPTOS PRELIMINARES
PROCESOS Y CAMBIOS DE ESTADO TIPOS DE PROCESOS Proceso irreversible. Son los procesos reales. En ellos siempre habr degradacin de energa y generacin de entropa. Pueden ser de dos tipos: Cuando se verifiquen por cambios no estticos (procesos de igualacin), tengan o no efectos disipativas (componentes tangenciales de la fuerza: fuerzas de viscosidad, rozamiento, efecto Joule, etc.) Cuando haya efectos disipativos, aunque se verifiquen a travs de cambios cuasiestticos.
47
CONCEPTOS PRELIMINARES
5. VOLUMEN ESPECFICO, PRESIN Y TEMPERATURA SON TRES PROPIEDADES INTENSIVAS PARTICULARMENTE
INTERESANTES EN TERMODINMICA. VOLUMEN ESPECFICO. PRESIN TEMPERATURA
48
CONCEPTOS PRELIMINARES
VOLUMEN ESPECFICO
Desde una perspectiva macroscpica, la descripcin de la materia se simplifica considerndola distribuida de modo continuo a lo largo de una regin. La validez de esta idealizacin, conocida como hiptesis del continuo, se deduce del hecho de que para un conjunto muy elevado de fenmenos de inters la descripcin resultante del comportamiento de la materia est de acuerdo con los datos medidos. Cuando las sustancias pueden ser tratadas como continuas es posible hablar de sus propiedades intensivas en un punto. As, en cualquier instante la densidad en un punto se define como:
= lim V V
m V
La densidad puede definirse como una funcin continua de la posicin y el tiempo.
49
CONCEPTOS PRELIMINARES
VOLUMEN ESPECFICO
La densidad es una propiedad intensiva que puede variar de un punto a otro dentro del sistema. As la masa asociada a un volumen particular V queda determinada, en principio, por la integracin:
m = dV
V
y no simplemente como un producto de la densidad por el volumen. A veces es conveniente expresar las propiedades sobre base molar en lugar de referirlas a la unidad de masa.
_
Para indicar esto se emplea la barra sobre el smbolo. As v significa volumen por kmol. Puesto que n = m/M (siendo M la masa molecular) la relacin entre v y es:
_
v =Mv
50
CONCEPTOS PRELIMINARES
PRESIN
El concepto de presin se introduce tambin desde el punto de vista continuo. La presin se define como la fuerza por unidad de superficie ejercida por un fluido sobre una superficie real o imaginaria, en direccin normal a la superficie. En unidades SI la presin se mide en newton por metro cuadrado (N/m2), unidad denominada Pascal (Pa).
Dos ladrillos iguales sobre un lecho de arena fina: Pone de manifiesto que lo que realmente influye no es el peso, sino la fuerza ejercida por ese cuerpo por unidad de superficie.
51
CONCEPTOS PRELIMINARES
PRESIN
En relacin con la presin atmosfrica, que es una referencia habitual, el N/m2 resulta una unidad demasiado pequea, por lo que se suele utilizar el bar, donde: 1 bar = 105 N/m2 = 0,1 MPa = 100 kPa 1 atm = 101 325 N/m2 = 1,01325 bar = 101,325 kPa
52
CONCEPTOS PRELIMINARES
QU ES LA PRESIN? En el caso de un gas: La presin es el resultado de los impactos de las molculas del gas contra la pared. Como las molculas se mueven en todas las direcciones, la presin es la misma con independencia de la orientacin de la pared donde se mide la presin es una magnitud escalar la presin es la misma en todas las direcciones.
53
CONCEPTOS PRELIMINARES
QU ES LA PRESIN?
Sin embargo la presin puede variar de un punto a otro dentro de un fluido en reposo. En el caso de lquidos, la presin se debe a la fuerza de la gravedad (peso) del lquido: se denomina presin hidrosttica.
54
CONCEPTOS PRELIMINARES
QU ES LA PRESIN?
Todas las presiones representan una medida de la energa potencial por unidad de volumen en un fluido. Para definir con mayor propiedad el concepto de presin en un fluido se distinguen habitualmente varias formas de medir la presin:
La presin media, o promedio de las presiones segn diferentes direcciones en un
fluido. Cuando el fluido est en reposo coincide con la presin hidrosttica.
La presin hidrosttica es la parte de la presin debida al peso de un fluido en reposo.
Es la presin que sufren los cuerpos sumergidos en un lquido o fluido por el simple y sencillo hecho de sumergirse dentro de ste. Se define por la frmula P = g h
La presin hidrodinmica es la presin termodinmica dependiente de la direccin
considerada alrededor de un punto que depender adems del peso del fluido, del estado de movimiento del mismo. 55
CONCEPTOS PRELIMINARES
LA PRESIN
A la hora de utilizar y determinar valores de la presin se puede hacer de dos formas:
Manejando presiones relativas manomtricas: se toma como base, o cero de medida,
la presin atmosfrica. Equipo de medida habitual el manmetro.
Presiones absolutas: se determinan tomando como base de referencia para efectuar la
medida el cero absoluto de presin. Es inmediato observar que la presin absoluta en un punto es la resultante de sumar, 1 kg/cm2 correspondiente al valor aproximado de la presin atmosfrica al valor medido por el manmetro de la presin relativa.
56
Presin absoluta, relativa y vaco
- 0.5
57
Unidades de presin. Equivalencias
1 Bar 1 Kg/cm2 14.5 p.s.i. 76 cm.Hg
58
Prdida de carga o cada de presin
Lquido en movimiento Rozamiento Calor (energa) Prdida de carga o cada de presin
Factores que influyen: Longitud tubera. Seccin tubera. Caudal. Viscosidad. Temperatura.
59
Prdida de carga o cada de presin
Presin por debajo de la atmosfrica
Presin atmosfrica
Bernouilli Venturi
Velocidad Presin
60
CONCEPTOS PRELIMINARES
LA TEMPERATURA
La temperatura es una propiedad esencial en Termodinmica. Su determinacin cuantitativa (medida) se realiza con instrumentos llamados
termmetros. La Ley Cero de la Termodinmica postula que es posible medir la temperatura, es decir, que la temperatura es una propiedad. La temperatura T es aquella propiedad que determina la capacidad de un sistema para intercambiar calor, siendo el calor una forma de transferir energa. Su unidad es el kelvin (K). Temperatura, por lo tanto, es una propiedad de los cuerpos, que no se puede disociar de la materia tangible, mientras que calor es energa y puede existir independientemente de la materia. 61
CONCEPTOS PRELIMINARES
LA TEMPERATURA
Suponemos dos subsistemas A y B cerrados de paredes adiabticas, definidos respectivamente por sus variables de equilibrio , ambos independientes entre s.
Si se sustituye la pared adiabtica que los separa por otra diatrmica, se observa experimentalmente que se rompe el equilibrio existente y cada sistema vara su estado hasta alcanzar estados de un nuevo equilibrio, que llamaremos de equilibrio trmico. Los nuevos valores de las variables de estado que definen dicho equilibrio ya no son, como antes, independientes, sino que estn ligados por una relacin. 62
CONCEPTOS PRELIMINARES
LA TEMPERATURA
Consideraciones como las anteriores nos llevan a inferir que los dos subsistemas tienen una propiedad fsica que determina cundo estn en equilibrio trmico. Esa propiedad es la temperatura y puede postularse que cuando dos sistemas estn en equilibrio trmico sus temperaturas son iguales. Si dos sistemas A y B estn en equilibrio trmico cada uno de ellos con un tercero C, los sistemas A y B estn en equilibrio trmico entre s.
63
CONCEPTOS PRELIMINARES
LA TEMPERATURA
Esto constituye el llamado Principio Cero de la Termodinmica, por el cual la existencia del equilibrio trmico entre dos sistemas puede verificarse a travs de un sistema intermedio llamado termmetro, sin necesidad de que los dos sistemas estn necesariamente en contacto a travs de una pared diatrmica. Cualquier cuerpo puede utilizarse como termmetro si tiene al menos una propiedad medible que cambia cuando su temperatura cambia. Tal propiedad se denomina propiedad termomtrica. Conclusin: los sistemas tiende de forma natural al equilibrio trmico.
64
CONCEPTOS PRELIMINARES
LA TEMPERATURA. ESCALAS DE TEMPERATURA
Antes de la formulacin de las leyes de la termodinmica y la fijacin de la escala absoluta, se usaron varias escalas empricas. Las ms conocidas de ellas se basan en la fijacin de dos puntos de referencia distintos, dividiendo el intervalo de temperaturas que media entre ambos en un cierto nmero de divisiones. Casi todas las escalas se basan en el agua, que es el fluido ms abundante y fcil de purificar, y toman el punto de congelacin y el punto de ebullicin como puntos de referencia, ambos a presin atmosfrica.
65
CONCEPTOS PRELIMINARES
LA TEMPERATURA. ESCALAS DE TEMPERATURA
La escala Celsius o centgrada asigna el valor 0 al punto de congelacin del agua y el valor 100 al punto de ebullicin quedando el intervalo dividido en 100 grados, de ah la denominacin de escala centgrada. La escala Fahrenheit asigna el valor 32 al punto de congelacin del agua y el valor 212 al punto de ebullicin normal quedando el intervalo dividido en 180 grados.
66
CONCEPTOS PRELIMINARES
ESCALAS DE TEMPERATURA
67
CONCEPTOS PRELIMINARES
LA TEMPERATURA. ESCALAS DE TEMPERATURA
Resumiendo: La temperatura es un parmetro fsico descriptivo de un sistema que caracteriza la transferencia de calor. Desde el punto de vista microscpico es una medida de la energa asociada al movimiento aleatorio de las partculas que componen el sistema (gases), o con la agitacin, vibracin y rotacin en el caso de los lquidos y slidos.
68
CONCEPTOS PRELIMINARES
MUCHO OJO A
69
DIAGRAMAS TERMODINMICOS
DIAGRAMAS TERMODINMICOS
Para aplicar el balance de energa a un sistema es preciso conocer sus propiedades y cmo se relacionan entre s. Las propiedades termodinmicas, como la energa interna y la entalpa, a partir de las cuales se calculan los requerimientos de calor y trabajo de los procesos industriales, a menudo se evalan a partir de datos volumtricos. Un diagrama de cualquier tipo es una representacin grfica de uno o ms conjuntos de datos numricos organizados en forma de tabla.
70
DIAGRAMAS TERMODINMICOS
DIAGRAMA DE ESTADO Es cualquier representacin de dos propiedades termodinmicas de un sistema. Un ejemplo tpico es el diagrama p-v-T. Estas realciones son en s mismas importantes para fines como medicin de fluidos y determinacin del tamao de recipientes y tuberas. Los diagramas p-v-T dan mucha informacin.
71
DIAGRAMAS TERMODINMICOS
DIAGRAMA p-v-T Define una superficie en un sistema de ejes coordenados p-v-T. Es la representacin en el espacio tridimensional de los estados posibles de un compuesto qumico.
72
DIAGRAMAS TERMODINMICOS
DIAGRAMA p-v-T Es una superficie discontinua, debindose las discontinuidades a los cambios de estado que sufre el compuesto al variarse las condiciones de presin y temperatura, que son las variables que suelen adoptarse como independientes en los estudios y clculos termodinmicos, principalmente por la relativa sencillez de su medida..
73
DIAGRAMAS TERMODINMICOS
DIAGRAMA p-v-T Las fases slida, lquida y gaseosa se representan por superficies. En estas regiones el estado queda definido por cualquiera dos de las propiedades presin, volumen especfico y temperatura. En el proceso de cambio de fase (fusin, vaporizacin, o sublimacin) coexisten dos fases. Dentro de las regiones bifsicas, la presin y la temperatura no son independientes; una no puede cambiar sin cambiar la otra tambin. En estas regiones el estado no puede fijarse por la temperatura y la presin; en cambio queda fijado con el volumen especfico y la presin o la temperatura.
74
DIAGRAMAS TERMODINMICOS
DIAGRAMA p-v-T
75
DIAGRAMAS TERMODINMICOS
DIAGRAMA p-v-T
La nica condicin en la que coexisten tres fases no es una zona, sino una delgada lnea que delimita dos zonas en las que coexisten dos fases. Diagrama para sustancia que se contrae al solidificarse.
76
DIAGRAMAS TERMODINMICOS
DIAGRAMA p-v-T
Diagrama para sustancia que se expande al solidificarse.
77
DIAGRAMAS TERMODINMICOS
DIAGRAMAS DE FASES
Para el anlisis termodinmico de los sistemas simples compresibles es ms conveniente trabajar con diagramas bidimensionales. Todos los diagramas bidimensionales son simples proyecciones de la superficie P-v-T. Pueden obtenerse tres diagramas: p-T, p-v, y T-v.
78
CONCEPTOS PRELIMINARES
DIAGRAMAS DE FASES
79
DIAGRAMAS TERMODINMICOS
DIAGRAMAS DE FASES
Las regiones bifsicas se reducen a lneas, y la lnea triple (regin de equilibrio de tres fases) se reduce a un punto, el punto triple.
Un vapor saturado se encuentra sobre la lnea de vapor saturado y un lquido
saturado sobre la lnea de lquido saturado.
La regin a la derecha de la lnea de vapor saturado es la regin
sobrecalentada.
La regin a la izquierda de la lnea de lquido saturado es la regin de lquido
comprimido (tambin llamada regin de lquido subenfriada).
Se encuentra un estado supercrtico cuando la presin y temperatura son
mayores a los valores crticos.
80
DIAGRAMAS TERMODINMICOS
81
DIAGRAMAS TERMODINMICOS
82
DIAGRAMAS TERMODINMICOS
DIAGRAMAS p-T
Los puntos que representan la coexistencia de dos fases son los que forman las curvas que se ven en el diagrama. El punto triple representa el nico punto en el que coexisten las tres fases. El punto triple del agua se utiliza como estado de referencia a la hora de definir las escalas de temperatura. Por convenio, la temperatura asignada al punto triple del agua es 273,16 K. La presin medida en el punto triple es 0,6113 kPa. Los sistemas monofsicos se representan mediante reas.
83
DIAGRAMAS TERMODINMICOS
DIAGRAMAS p-T
Las pendientes de las curvas de sublimacin y vaporizacin son siempre positivas. En cambio la pendiente de la curva de fusin puede ser positiva o negativa. En el caso del diagrama siguiente la pendiente es negativa. Qu dice esto? Si la pendiente es negativa, esta sustancia se contrae al fundirse, lo que significa que el slido tiene menor densidad.
84
DIAGRAMAS TERMODINMICOS
DIAGRAMAS p-T
85
DIAGRAMAS TERMODINMICOS
DIAGRAMAS p-v
86
DIAGRAMAS TERMODINMICOS
DIAGRAMAS p-v
El vapor que se encuentra en equilibrio con su lquido (es decir,
dentro de la zona de coexistencia de fases) se suele llamar vapor hmedo.
El vapor situado a la derecha de la curva de puntos de roco se
denomina vapor recalentado o vapor seco.
El vapor que est sobre la curva de puntos de roco se suele llamar
vapor saturado seco.
La curva que forma el conjunto de los puntos de burbuja y de los
87
puntos de roco es llamada curva de Andrews.
DIAGRAMAS TERMODINMICOS
DIAGRAMAS T-v
Para facilitar el uso del mismo se representan isobaras. Para temperaturas menores a la crtica se ve que la temperatura permanece constante con la presin al atravesar la regin bifsica. Para las regiones monofsicas la temperatura aumenta para una presin dada cuando el volumen especfico aumenta. Para presiones mayores a la presin crtica, la temperatura aumenta continuamente para una presin dada cuando el volumen especfico tambin aumenta, no atravesndose la regin bifsica.
88
DIAGRAMAS TERMODINMICOS
DIAGRAMAS T-v
89
DIAGRAMAS TERMODINMICOS
CAMBIOS DE FASE Es instructivo estudiar alguno de los fenmenos que se presentan cuando una sustancia pura sufre un cambio de fase. Se un sistema cerrado con 1 kg masa de agua lquida a 20 C contenido en un dispositivo cilindro- pistn. Se supone que el agua se calienta lentamente manteniendo su presin constante y uniforme en todo el sistema e igual a 1,014 bar.
90
DIAGRAMAS TERMODINMICOS
CAMBIOS DE FASE Cuando el sistema se calienta a presin constante, la temperatura aumenta considerablemente mientras que el volumen especfico aumenta ligeramente. En un momento dado el lquido est en estado saturado. Para el agua a 1,014 bar la temperatura de saturacin es 100 C. Cuando el sistema est en el estado de lquido saturado, el suministro de un flujo de calor adicional, a presin constante, da lugar a la formacin de vapor sin cambios en la temperatura pero con un aumento considerable en el volumen especfico.
91
DIAGRAMAS TERMODINMICOS
CAMBIOS DE FASE
Cuando una mezcla de lquido-vapor existe en equilibrio, la fase lquida es lquido saturado y la fase vapor es vapor saturado. Si el sistema se sigue calentando hasta que la ltima porcin de lquido se haya vaporizado, se alcanza de vapor saturado. Las diferentes mezclas bifsicas lquido-vapor que se dan en el proceso pueden distinguirse una de otra por su ttulo, x, que es una propiedad intensiva.
92
DIAGRAMAS TERMODINMICOS
v = (1 x)v f + xv g
93
DIAGRAMAS TERMODINMICOS
CAMBIOS DE FASE
Consideremos ahora el comportamiento del sistema cuando se calienta a la presin crtica. En todos los estados existe una nica fase. La vaporizacin se presentan slo cuando la presin es menor que la presin crtica. Cuando la temperatura y la presin son superiores a los respectivos valores crticos, los trminos lquido y vapor tienden a perder su significado. En tales estados una sustancia es descrita ms apropiadamente por la denominacin de fluido.
94
DIAGRAMAS TERMODINMICOS
95
DIAGRAMAS TERMODINMICOS
ECUACIN DE ESTADO
Cualquier ecuacin que relacione la presin, la temperatura y el volumen especfico de una sustancia se denomina ecuacin de estado. El diagrama PV para una sustancia pura indica la complejidad del comportamiento PvT de una sustancia pura y sugiere la dificultad de su descripcin mediante una ecuacin. Hay varias ecuaciones de estado, algunas sencillas y otras muy complejas: la ms sencilla y mejor conocida para sustancias en la fase gaseosa es la ecuacin de estado de gas ideal, la cual predice el comportamiento P-v-T de un gas con bastante exactitud, dentro de cierta regin elegida adecuadamente.
pV = n RT
96
DIAGRAMAS TERMODINMICOS
FORMAS DE LA ECUACIN EN FUNCIN DE LAS TRANSFORMACIONES TERMODINMICAS
TRANSFORMACIN ISOCRICA O ISOMTRICA
Un proceso isomtrico se lleva a cabo a volumen constante. En dicho proceso el trabajo es cero. la primera ley: U = Q
Esto significa que si se agrega calor a un sistema manteniendo el volumen constante, todo el calor se utiliza para aumentar la energa interna del sistema.
97
DIAGRAMAS TERMODINMICOS
FORMAS DE LA ECUACIN EN FUNCIN DE LAS TRANSFORMACIONES TERMODINMICAS
TRANSFORMACIN ISOBRICA. p = cte.
Tanto el calor transferido como el trabajo realizado no son cero. El trabajo simplemente se define como la presin multiplicada por el cambio de volumen. W = P (Vf Vi)
98
DIAGRAMAS TERMODINMICOS
FORMAS DE LA ECUACIN EN FUNCIN DE LAS TRANSFORMACIONES TERMODINMICAS
TRANSFORMACIN ISOTERMA. T = cte
La grfica de P contra V a temperatura constante toma la forma de una curva llamada isoterma. Para un gas ideal la isoterma es una curva hiperblica.
99
DIAGRAMAS TERMODINMICOS
FORMAS DE LA ECUACIN EN FUNCIN DE LAS TRANSFORMACIONES TERMODINMICAS
TRANSFORMACIN ADIABTICA Q = 0., por lo que U = -W
Este proceso se puede lograr ya sea aislando trmicamente el sistema de sus alrededores o realizando el proceso rpidamente.
Realizando un proceso adiabtico en un gas, podemos observar que si se expande, W es positivo y por lo tanto U es negativo y el gas se enfra. De manera recproca, si se comprime adiabticamente, el gas se calienta.
100
DIAGRAMAS TERMODINMICOS
101
DIAGRAMAS TERMODINMICOS
102
You might also like
- EstequiometriaDocument25 pagesEstequiometriaexplomolinNo ratings yet
- 2 Normativa PESC CompletaDocument54 pages2 Normativa PESC CompletaexplomolinNo ratings yet
- Fasciculo1 El Mundo de La QuimicaDocument8 pagesFasciculo1 El Mundo de La QuimicaB Azucena100% (2)
- EstequiometriaDocument25 pagesEstequiometriaexplomolinNo ratings yet
- Adaptación de Animales Al Clima - SocialesDocument9 pagesAdaptación de Animales Al Clima - SocialesexplomolinNo ratings yet
- 42 - Enlace Covalente - Orbitales MolecularesDocument17 pages42 - Enlace Covalente - Orbitales MolecularesexplomolinNo ratings yet
- Disoluciones ReguladorasDocument11 pagesDisoluciones ReguladorasexplomolinNo ratings yet
- Propiedades Del AguaDocument1 pagePropiedades Del AguaGilber Alejandro Briceño CarreroNo ratings yet
- El Agua y Sus FuncionesDocument29 pagesEl Agua y Sus FuncionesexplomolinNo ratings yet
- 42 - Enlace Covalente - Orbitales MolecularesDocument17 pages42 - Enlace Covalente - Orbitales MolecularesexplomolinNo ratings yet
- Equilibrios Acido BaseDocument20 pagesEquilibrios Acido BaseexplomolinNo ratings yet
- Plan Territorial Costas Cabo Negro-PodesDocument1 pagePlan Territorial Costas Cabo Negro-PodesexplomolinNo ratings yet
- Valoraciones Acido-BaseDocument11 pagesValoraciones Acido-BaseexplomolinNo ratings yet
- 57 - Conceptos de Oxidación-ReducciónDocument41 pages57 - Conceptos de Oxidación-ReducciónexplomolinNo ratings yet
- 32 - Sist Materiales. Mezclas, Sust Puras y ElementosDocument34 pages32 - Sist Materiales. Mezclas, Sust Puras y ElementosexplomolinNo ratings yet
- Plantas GotermicasDocument35 pagesPlantas GotermicasexplomolinNo ratings yet
- Breve Historia Sobre MoisésDocument8 pagesBreve Historia Sobre Moisésexplomolin100% (1)
- Manual Separador ModeloigcDocument25 pagesManual Separador ModeloigcexplomolinNo ratings yet
- Pablo de TarsoDocument8 pagesPablo de TarsoexplomolinNo ratings yet
- El Santo SudarioDocument6 pagesEl Santo SudarioexplomolinNo ratings yet
- El Santo SudarioDocument6 pagesEl Santo SudarioexplomolinNo ratings yet
- Pablo de TarsoDocument8 pagesPablo de TarsoexplomolinNo ratings yet
- Los Primeros CristianosDocument8 pagesLos Primeros CristianosexplomolinNo ratings yet
- Evolucion Desalacion en EspañaDocument20 pagesEvolucion Desalacion en EspañaexplomolinNo ratings yet
- Tipo de PurgadoresDocument15 pagesTipo de PurgadoresexplomolinNo ratings yet
- Turbinas de gas: introducción y clasificaciónDocument41 pagesTurbinas de gas: introducción y clasificaciónexplomolin100% (1)
- Lubricación de RodamientosDocument31 pagesLubricación de RodamientosexplomolinNo ratings yet
- Diseño Linea de FangosDocument63 pagesDiseño Linea de Fangosexplomolin100% (1)
- Turbinas de VaporDocument5 pagesTurbinas de VaporexplomolinNo ratings yet
- Medidores de TemperaturaDocument11 pagesMedidores de TemperaturaCarlos Castañon SanchezNo ratings yet
- Primera Ley PDFDocument37 pagesPrimera Ley PDFCarleny M LárezNo ratings yet
- Termodianmica Semana 3Document81 pagesTermodianmica Semana 3Sebastian CuervoNo ratings yet
- Actividad Calificada - Examen FinalDocument9 pagesActividad Calificada - Examen FinalJordy RamirezNo ratings yet
- Evaluación Ciencias Naturales Yartiza MamaniDocument3 pagesEvaluación Ciencias Naturales Yartiza MamaniIvonne ContrerasNo ratings yet
- Informe de LaboratorioDocument9 pagesInforme de Laboratoriodarwin rojasNo ratings yet
- Guia de Trabajo N.1 Mayo2021 BioenergíaDocument31 pagesGuia de Trabajo N.1 Mayo2021 BioenergíaKelly RuizNo ratings yet
- Resumen FinalDocument10 pagesResumen FinalNahue MaureiraNo ratings yet
- Diagrama de Fases BinariosDocument6 pagesDiagrama de Fases BinariosTeresa MantillaNo ratings yet
- Aplicaciones 1ra ley termodinámicaaplicalaprimeraleydelatermodinámicaDocument8 pagesAplicaciones 1ra ley termodinámicaaplicalaprimeraleydelatermodinámicaAngel VinuezaNo ratings yet
- Infografía TermodinámicaDocument1 pageInfografía TermodinámicaBrenda Alarcón100% (1)
- If CalorimetriaDocument10 pagesIf CalorimetriaCIELO GUADALUPE GUTIERREZ CARBAJALNo ratings yet
- Mini Split 10 AirwayDocument3 pagesMini Split 10 AirwayEstudio AmbroisNo ratings yet
- Calefacción A GasDocument11 pagesCalefacción A GasIvanovDu100% (2)
- V. - Condición de Contorno Isotérmica en Sólidos InfinitosDocument11 pagesV. - Condición de Contorno Isotérmica en Sólidos InfinitosFrancisco González De BritoNo ratings yet
- Punto de FusionDocument5 pagesPunto de FusionMiguel Rodriguez0% (1)
- Tipos de CalderasDocument7 pagesTipos de CalderasJose Manuel Reyes HernandezNo ratings yet
- Cuadro Sinóptico-Mapa Conceptual Unidad 4 Jafeth Gamboa BaasDocument1 pageCuadro Sinóptico-Mapa Conceptual Unidad 4 Jafeth Gamboa BaasDarksoul 2703No ratings yet
- Secador de CharolasDocument14 pagesSecador de CharolasJahzeel MuñozNo ratings yet
- Tarea TermoDocument12 pagesTarea TermoANDRE ROSALES SAAVEDRANo ratings yet
- Temperatura PDFDocument9 pagesTemperatura PDFAndrea Valeria Quirita VargasNo ratings yet
- Constante de Equilibrio de La UreaDocument13 pagesConstante de Equilibrio de La UreaMartín PaucarNo ratings yet
- Liquido RefrigeranteDocument7 pagesLiquido RefrigeranteCARLOS BELTRÁNNo ratings yet
- Laboratory N° 4Document8 pagesLaboratory N° 4luis4enrique4tarazonNo ratings yet
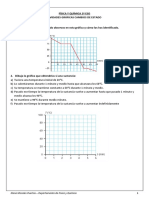
- Act - Gráficos Cambios de EstadoDocument2 pagesAct - Gráficos Cambios de EstadoElenaNo ratings yet
- Cap 2 Clasificacion de Los Fluidos en El Reservorio PDFDocument23 pagesCap 2 Clasificacion de Los Fluidos en El Reservorio PDFJuan Ariel Aspi ApazaNo ratings yet
- Coeficiente de transferencia de masa y espesor de película en absorción de amoniacoDocument14 pagesCoeficiente de transferencia de masa y espesor de película en absorción de amoniacoLis Barrera Cocunubo100% (2)
- Guia de Laboratorio 4. - Calor de NeutralizacionDocument3 pagesGuia de Laboratorio 4. - Calor de NeutralizacionJhojans Enrriquex riveraNo ratings yet
- Modelo Matemático de Van Der WaalsDocument4 pagesModelo Matemático de Van Der WaalsSelegna PachecoNo ratings yet
- Termo CuestionsDocument4 pagesTermo CuestionsstepaniukNo ratings yet