Professional Documents
Culture Documents
Ley de Boyle (Practica 2)
Uploaded by
Emmanuel Dorantes MolinaOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Ley de Boyle (Practica 2)
Uploaded by
Emmanuel Dorantes MolinaCopyright:
Available Formats
INSTITULO POLITECTICO NACIONAL
ESCUELA NACIONAL DE CIENCIAS BIOLGICAS
INGENIERA BIOQUMICA
LABORATORIO DE FISICOQUMICA
LEY DE CHARLES-GAY LUSSAC
Ingeniero Sui Morales Enrique.
Integrantes:
Campa Gmez Omar.
Dorantes Molina Alba Paloma.
Puga Carbajal Melissa Rebeca.
Fecha:
INTRODUCCION.
El estado gaseoso de la materia, se caracteriza porque sus fuerzas de cohesin son muy dbiles,
encontrndose as sus tomos o molculas muy separados el uno del otro. Las molculas de los
gases se encuentran movindose libremente debido a dicho espacio, chocando as con las paredes
del recipiente que las contiene; lo cual origina la presin del gas. Si aumenta la temperatura la
velocidad con la que se mueven las molculas ser mayor, generando as un volumen mayor.
OBJETIVO.
Determinar si el aire en las condiciones ambientales nos permite obtener la relacin entre la
presin y el volumen descrita por Boyle-Mariotte.
DESARROLLO EXPERIMENTAL.
MATERIAL:
Aparato de Boyle.
1 regla.
Con el dimetro del tubo y el valor de la longitud de la columna, podremos calcular fcilmente el
volumen.
Cmo?
Cmo puedes calcular la presin?
Para obtener la presin del sistema, se sum la presin manomtrica con la presin atmosfrica, la cual a
la hora del experimento fue de 585 .
En el aparato de boyle que
consiste de un manometro
cargado con mercurio y una
masa constante de aire.
Se mueve hacia arriba la
rama que esta libre a la
presion de la atmosfera.
Se sube hasta el maximo la
rama, y se toma la medida
del mercurio de la rama
cerrada hacia el tubo cerrado
y la diferencia de alturas de
las 2 ramas.
Se toman de 10 a 15
mediciones bajando
gradualmente la
rama movible del
manometro
Se registra la ultima
medicion cuando el
nivel de mercurio en
ambas ramas sea el
mismo.
RESULTADOS.
TABLA DE VALORES OBTENIDOS.
Presin
manomtrica
Presin del
sistema
Longitud h
Volumen
0 585 35.2 6.91
11 596 34.7 6.81
15 600 34.2 6.71
28 613 34 6.67
34 619 33.7 6.61
41 626 33.2 6.51
48 633 33.1 6.49
53 638 32.6 6.40
65 650 32 6.28
70 655 31.8 6.24
72 656 31.5 6.18
80 665 31 6.08
95 680 30.9 6.06
100 685 30.4 5.96
105 690 29.9 5.87
110 695 29.7 5.83
114 699 29.6 5.81
120 705 29.4 5.77
130 715 29 5.69
140 725 28.6 5.61
Convirtiendo y de
Sabemos que y
Presin del
sistema
Presin del
sistema
Volumen
Volumen
585 0.769 6.91
-2.160 -0.114
596 0.784 6.81
-2.166 -0.105
600 0.789 6.71
-2.173 -0.102
613 0.806 6.67
-2.175 -0.093
619 0.814 6.61
-2.179 -0.089
626 0.823 6.51
-2.186 -0.084
633 0.832 6.49
-2.187 -0.079
638 0.839 6.40
-2.193 -0.076
650 0.855 6.28
-2.202 -0.068
655 0.861 6.24
-2.204 -0.064
656 0.864 6.18
-2.209 -0.063
665 0.875 6.08
-2.216 -0.057
680 0.894 6.06
-2.217 -0.048
685 0.901 5.96
-2.224 -0.045
690 0.907 5.87
-2.231 -0.042
695 0.914 5.83
-2.234 -0.039
699 0.919 5.81
-2.235 -0.036
705 0.927 5.77
-2.238 -0.032
715 0.940 5.69
-2.244 -0.026
725 0.953 5.61
-2.251 -0.020
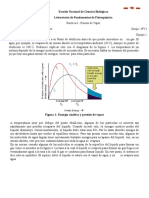
La grfica anterior corresponde a la ecuacin de Boyle para los gases ideales:
De donde obtenemos que:
Para que la grfica sea una lnea recta, con una ecuacin de la forma , se tiene:
Se sabe que
, por lo que al sustituir en la ecuacin anterior, se tiene:
Valores de y . Obtenidos con la calculadora.
Haciendo un anlisis dimensional:
De lo anterior obtenemos que a es la presin ideal a la que el volumen es igual a 0, mientras que b es un
exponente en la ecuacin
, por lo que no tiene unidades, y a partir de la ecuacin anterior, se
sabe que
, por lo que:
Y por un nuevo anlisis dimensional, tenemos que:
De donde concluimos que k es una contante del gas, que se mide en
Obteniendo como ecuacin final:
Tu experimento requiere que la temperatura sea constante para poder realizarse. Cmo sabias se
esto es o no cierto durante el mismo, si no tenas termmetro para verificarlo?
Porque no se aplic calor al sistema en ningn momento y la temperatura ambiental no cambia
drsticamente.
N moles de gas, inicialmente bajo una presin de 1atm
y temperatura de 0C
) ocupan un
volumen de
. Este gas se somete a los cambios siguientes:
a) A presin constante
se calienta hasta una temperatura T y un volumen
.
b) A temperatura constante T se varia su volumen y presin has P y V.
Utilizando la ley de Charles, Gay Lussac y Boyle que obtuviste en estos experimentos, encuentra la
ecuacin general de los gases.
Ley de Charles.
Combinando en una sola ecuacin la ley de Boyle y la ley de Charles se obtiene:
Para un mol de gas, la constante que aparece en el segundo miembro de la ecuacin anterior, es la
constante universal de los gases ideales ; por lo que la ecuacin general de los gases es:
DISCUSIN DE RESULTADOS.
En este experimento, se tomaron en cuenta 2 criterios que variaron, siendo volumen y presin del
sistema, teniendo la temperatura constante; esto es un proceso isotrmico. Gracias a los datos
experimentales obtenidos nos podemos dar cuenta que la presin y el volumen no est directamente
relacionados, ya que al tener una presin menor el volumen era mayor, y al obtener un volumen menor
la presin disminua, no son proporcionales, o son, inversamente proporcionales. Dado que es una
relacin inversa es decir que si aumenta presin disminuye volumen o si disminuye la presin aumenta
el volumen se puede plantear la siguiente ecuacin. Esto se puede observar con mayor facilidad en la
grfica 1 , ya que se puede observar una curvatura, al pasar estos datos a una grfica logartmica se
puede observar la recta que se obtiene, por lo que presin y volumen estarn inversamente relacionados.
En la grfica logartmica se puede observar que no todos los puntos estn conectados en la recta, esto
nos dice que hubo errores experimentales, que puede ser el no medir de manera correcta la distancia del
mercurio en la rama cerrada al extremo de la misma rama, o no medir bien la diferencia de distancias
entre los niveles de mercurio, o que al momento de la medicin de las distancias estas se hayan sido
visto afectadas a que la persona que sostena el tubo lo subi un poco o lo pudo haber bajado, estos son
los posibles errores experimentales.
CONCLUCION.
Con los resultados arrojados en el experimento y al ser estos graficados; comprobamos la ley de Boyle
La presin de un gas a una temperatura constante, es inversamente proporcional al volumen del gas. Y
pudimos obtener dicha comprobacin trabajando con aire en condiciones ambientales.
BIBLIOGRAFIA.
Gilbert W. Castelln (2004), Fisicoqumica, Pearson Educacin, Mxico
Ira N. Levine (2003), Fisicoqumica, Mc GrawHill, Espaa
You might also like
- Practica 3 Ley de BoyleDocument2 pagesPractica 3 Ley de BoyleLeonardo ZamudioNo ratings yet
- Practica 1 Fisicoquimica Ley de BoyleDocument7 pagesPractica 1 Fisicoquimica Ley de BoyleCarlitos HernandezNo ratings yet
- Copia de Ley de CharlesDocument3 pagesCopia de Ley de CharlesBenjamin GonzalezNo ratings yet
- PRACTICA 7 DETERMINACION DE E° Y No DE ELECTRONESDocument13 pagesPRACTICA 7 DETERMINACION DE E° Y No DE ELECTRONESEdwin CastañedaNo ratings yet
- Reporte 1 FisicoquimicaDocument9 pagesReporte 1 FisicoquimicaAdriana Reyes CervantesNo ratings yet
- Practica Final RefractometriaDocument11 pagesPractica Final RefractometriaArmando Darien SantiagoNo ratings yet
- Practica 6 - Capacidades CalorificasDocument11 pagesPractica 6 - Capacidades CalorificasYoali Asiain LeconaNo ratings yet
- Practica 3 DensidadDocument6 pagesPractica 3 DensidadBlackPork54No ratings yet
- Practica 7 - Determinación de Calor de CombustiónDocument11 pagesPractica 7 - Determinación de Calor de CombustiónYoali Asiain LeconaNo ratings yet
- PRÀCTICA N6 Acido Fumarico Final FinalDocument5 pagesPRÀCTICA N6 Acido Fumarico Final FinalJossLunaNo ratings yet
- Practica 4 FISICA Plano InclinadoDocument10 pagesPractica 4 FISICA Plano InclinadoguillermoNo ratings yet
- Determinación de la tensión superficial por el método ascendenteDocument8 pagesDeterminación de la tensión superficial por el método ascendenteRamon GarciaNo ratings yet
- Propiedades coligativas de solucionesDocument14 pagesPropiedades coligativas de solucionesChava HernandezNo ratings yet
- Práctica 9Document9 pagesPráctica 9Rosalba HernándezNo ratings yet
- Capacidad Calorífica: Análisis de Procesos Isotérmicos y AdiabáticosDocument6 pagesCapacidad Calorífica: Análisis de Procesos Isotérmicos y AdiabáticosRaúl FonsecaNo ratings yet
- CiclohexanoximaDocument3 pagesCiclohexanoximaFernanda DomínguezNo ratings yet
- Quimica Organica Practica 7 Cinetica QuimicaDocument4 pagesQuimica Organica Practica 7 Cinetica QuimicaGilberto Labra0% (1)
- Practica 8. - Presion de VaporDocument11 pagesPractica 8. - Presion de VaporJohn Víctor33% (3)
- Cinética QuímicaDocument8 pagesCinética QuímicaLeslie ingrid VenegasNo ratings yet
- Practica Capacidad Calorifica de Los GasesDocument9 pagesPractica Capacidad Calorifica de Los GasesAngel Ortega GasparNo ratings yet
- Síntesis ácido fumárico microescalaDocument4 pagesSíntesis ácido fumárico microescalaMariand F Morales100% (1)
- Obtención ácido fumárico cis-transDocument4 pagesObtención ácido fumárico cis-transzackdricklNo ratings yet
- Práctica 5 FísicaDocument7 pagesPráctica 5 FísicaDiegoSeguraNo ratings yet
- Bitacora 12 LevadurasDocument9 pagesBitacora 12 LevadurasSponja75No ratings yet
- Practica 6 Capacidades CalorificasDocument5 pagesPractica 6 Capacidades CalorificasDomingo GuerraNo ratings yet
- Caída AmortiguadaDocument8 pagesCaída AmortiguadaAdriana Perez100% (2)
- Práctica 1 Química Orgánica ENCBDocument3 pagesPráctica 1 Química Orgánica ENCBEmriel9650% (2)
- Curvas de TitulacionDocument2 pagesCurvas de TitulacionBertario Ríos García100% (2)
- Practica 8 Propiedades ColigativasDocument5 pagesPractica 8 Propiedades ColigativasBlackPork54No ratings yet
- Ley de Charles: Relación entre volumen y temperaturaDocument3 pagesLey de Charles: Relación entre volumen y temperaturaLeslie ingrid VenegasNo ratings yet
- Práctica 3. Mediciones de PH y Capacidad ReguladoraDocument12 pagesPráctica 3. Mediciones de PH y Capacidad ReguladoralizNo ratings yet
- PRÁCTICA 9 Isomería I.Q. Fes CuautitlanDocument5 pagesPRÁCTICA 9 Isomería I.Q. Fes CuautitlanJose Emmanuel ChemaNo ratings yet
- P3 Balance de Masa en Un Mezclado (Fracción Masica) - Ok - OK PDFDocument22 pagesP3 Balance de Masa en Un Mezclado (Fracción Masica) - Ok - OK PDFHelen100% (1)
- Practica Titulacion Conductimetrica y Mediciones ConductividadDocument7 pagesPractica Titulacion Conductimetrica y Mediciones ConductividadTann MoralesNo ratings yet
- Practica 4 TermoquimicaDocument4 pagesPractica 4 TermoquimicaBlackPork54No ratings yet
- Bitacora No.11Document6 pagesBitacora No.11Sponja75No ratings yet
- Práctica 4. Adsorción II.Document4 pagesPráctica 4. Adsorción II.Gibran Meza Castrejon100% (1)
- Cinética Química Práctica FisicoquímicaDocument3 pagesCinética Química Práctica FisicoquímicaLilu Wrathe Tempest100% (1)
- Práctica 7 FisicoquímicaDocument7 pagesPráctica 7 FisicoquímicaFernando HGNo ratings yet
- Práctica 3 ''Mediciones de PH y Capacidad Reguladora''Document4 pagesPráctica 3 ''Mediciones de PH y Capacidad Reguladora''miriam aldamaNo ratings yet
- Practica 6 Síntesis de DibenzalacetonaDocument26 pagesPractica 6 Síntesis de DibenzalacetonaVan_der_WaalsNo ratings yet
- Presion HidrostaticaDocument6 pagesPresion HidrostaticaOctavio S. SolisNo ratings yet
- Práctica 2 Ley de BoyleDocument13 pagesPráctica 2 Ley de BoyleluuisNo ratings yet
- Qué Es Un ColoideDocument1 pageQué Es Un ColoideMiiky De Giio R. M100% (1)
- Síntesis A Microescala de Acido FumáricoDocument2 pagesSíntesis A Microescala de Acido FumáricoMar Dz H0% (1)
- Practica7 Cinetica de Las Reacciones QuimicasDocument6 pagesPractica7 Cinetica de Las Reacciones QuimicasLuis AngelNo ratings yet
- Practica Compuestos de CoordinacionDocument2 pagesPractica Compuestos de CoordinacionEva Mariana Torres0% (1)
- Practica 8 Termo¡Document13 pagesPractica 8 Termo¡Venus Almazan RojasNo ratings yet
- Síntesis A Microescala de Ácido FumaricoDocument2 pagesSíntesis A Microescala de Ácido FumaricoKarlaNo ratings yet
- Biologia MicroscopioDocument2 pagesBiologia MicroscopioAilyn CytlalliNo ratings yet
- PRÁCTICA No 13Document5 pagesPRÁCTICA No 13Fernanda DomínguezNo ratings yet
- Practica 9 Adsorción IiDocument11 pagesPractica 9 Adsorción IiedwinNo ratings yet
- Reporte Practica 1 RefractometriaDocument12 pagesReporte Practica 1 RefractometriaGustav ValenciaNo ratings yet
- Práctica 1 RefractometriaDocument8 pagesPráctica 1 RefractometriaFernanda CazaresNo ratings yet
- Practica 3 RecristalizacionDocument4 pagesPractica 3 RecristalizacionValeriaNo ratings yet
- Práctica 4 - TermoquímicaDocument3 pagesPráctica 4 - TermoquímicaChuck ÜbermenschNo ratings yet
- Cristales líquidos benzoato colesteriloDocument4 pagesCristales líquidos benzoato colesteriloPoncho MalagónNo ratings yet
- Cuestionario Levaduras BiologiaDocument3 pagesCuestionario Levaduras BiologiaAlejandraSánchezNo ratings yet
- Practica de Capacidad CalorificaDocument11 pagesPractica de Capacidad CalorificaArmando Darien Santiago100% (1)
- Practica 2 Coeficiente de Expansion de Los GasesDocument11 pagesPractica 2 Coeficiente de Expansion de Los GasesDeyanni AlvarezNo ratings yet
- Curso DesgasteDocument117 pagesCurso DesgasteMarcos Matias MedinaNo ratings yet
- Cinética Química: Análisis de Órdenes de Reacción y Teorías CinéticasDocument4 pagesCinética Química: Análisis de Órdenes de Reacción y Teorías CinéticasCamilo RamirezNo ratings yet
- CapacitanciaDocument7 pagesCapacitanciabyronNo ratings yet
- EcotecniasDocument6 pagesEcotecniasDafne CTNo ratings yet
- Quinto grado de secundaria: Resolución de problemas matemáticosDocument4 pagesQuinto grado de secundaria: Resolución de problemas matemáticosAristo Enrique Valeriano FernandezNo ratings yet
- Conservación de La EnergíaDocument28 pagesConservación de La Energíawelkyspastora175% (4)
- Introducción Al Modelado de Sistemas FísicosDocument3 pagesIntroducción Al Modelado de Sistemas FísicosYusei PeregrinoNo ratings yet
- Aminas químicasDocument3 pagesAminas químicasprimekronosNo ratings yet
- Ejercicios Propuestos Tema6 16-17Document2 pagesEjercicios Propuestos Tema6 16-17Fabian Arellano100% (1)
- Taller Física 3Document2 pagesTaller Física 3Juan Arregoces Martes0% (1)
- Tablas Apendice B PDFDocument3 pagesTablas Apendice B PDFIsrael BorjaNo ratings yet
- Practica 5 GeomecánicaDocument6 pagesPractica 5 GeomecánicaPercy Chambe BahamondesNo ratings yet
- Diagrama de fases Pb-SnDocument26 pagesDiagrama de fases Pb-SnKevin YamunaqueNo ratings yet
- Termofluidos Ing MecatronicaDocument9 pagesTermofluidos Ing Mecatronicaluis13071980No ratings yet
- Lista de Chequeo MMC - AgostoDocument3 pagesLista de Chequeo MMC - AgostoJohanaSotoNo ratings yet
- Leal, Mauro R - La Radiestesia El Oraculo Del MovimientoDocument29 pagesLeal, Mauro R - La Radiestesia El Oraculo Del Movimientocmct100% (1)
- Guantes nitrilo protección químicaDocument30 pagesGuantes nitrilo protección químicaVanessa HernandezNo ratings yet
- Ejercicios Teoría ElectromagneticaDocument17 pagesEjercicios Teoría ElectromagneticaJose Manuel Caldera100% (1)
- Nomenclatura Binarios 2012 (III)Document6 pagesNomenclatura Binarios 2012 (III)Eddie PospoyNo ratings yet
- ElectrostáticaDocument4 pagesElectrostáticaBonitzuZTNo ratings yet
- Metodología Construcción AeropuertoDocument11 pagesMetodología Construcción AeropuertoAndrésCarreraSilvaNo ratings yet
- 04 Informe Física IIIDocument26 pages04 Informe Física IIIMilene100% (1)
- Visita A La Planta de Fundicion de VintoDocument2 pagesVisita A La Planta de Fundicion de VintoCelia Huarayo100% (1)
- Vertederos y Canales de DescargasDocument32 pagesVertederos y Canales de DescargasMaria González100% (4)
- 1874-FM 21 - Ejercicios Mecánica II B SA-7%Document32 pages1874-FM 21 - Ejercicios Mecánica II B SA-7%Portgas D AceNo ratings yet
- Preparacion de SolucionesDocument10 pagesPreparacion de Solucionesjcastro_290191No ratings yet
- ArmonicosDocument29 pagesArmonicosDanielsam BorquezNo ratings yet
- MapaDocument1 pageMapaFernando Delgadillo0% (1)